

2015-2020年中国医药创新发展回顾及展望之二
资本投入助力医药创新
“重大新药创制”科技重大专项对于推动中国研发跨越式发展、实现由医药大国向医药强国转变起到了重要的引领和催生作用。作为中国中长期科技发展计划的重要组成部分,“重大新药创制”科技重大专项于2008年启动,通过十一五和十二五期间的“铺”和“梳”,初步建立起创新研发平台和共性技术平台;十三五期间以“培育重大产品、满足重点需求、解决重点问题”,实现“突”的跨越。专项三个阶段的实施到2020年收官,中央财政共投入233亿元,对3000多个课题提供了支持,针对10类重大疾病的自主创新品种成果斐然。政府对于医药创新的持续投入,有助于激发医药科技工作者的创新积极性,紧跟新一代医药创新技术的全球步伐。
政府资金投入和政策环境改善极大地调动了社会资本投入创新药的积极性。中国医药医疗领域的风险投资和私募基金投资2015年仅有120亿元,2020年达到了1850亿元(其中三分之一聚焦新药研发),增长了14倍多。
投资者对于中国创新药企业和市场潜力的认可也体现在中国医药创新企业的上市数量和市值增长方面。2020年共有超过20家中国生物科技公司上市,在科创板、港交所、纳斯达克上市的中国生物科技公司的总市值从2016年的不足百亿元快速上升到2020年底的过万亿元。资本市场对中国医药市场和中国生物科技公司的发展前景普遍看好,2020年全球生物医药企业市值排行榜显示,中国有六家上市公司进入全球医药企业市值前五十名:恒瑞医药、豪森药业、药明生物、中国生物制药、石药集团和百济神州。在当前社会资本对创新药的投资热潮中,需要着眼长远,从投资拉动到市场回报支撑转化,以确保医药创新产业的可持续发展。创新药研发投资巨大(不考虑风险,单个创新药物的平均研发成本高达15亿元),新药上市后,若因为市场准入、定价支付、知识产权保护等因素不能及时获得合理经济回报,就会打击投资者和企业对于研发投入的积极性。医药创新产业的可持续性发展与完善的创新药支付体系和知识产权保护体系息息相关。
创新主体能力升级带动创新
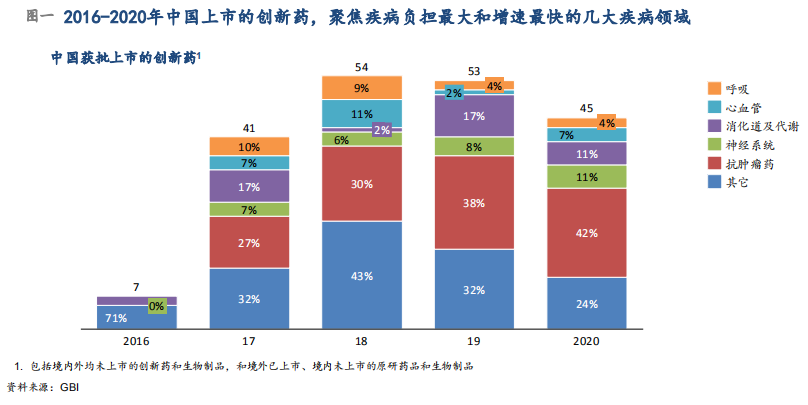
本土与跨国药企研发上市新药,聚焦中国病患未满足的临床需求。过去五年来,中国共上市200个创新药产品,聚焦国内疾病负担最大和增速最高的疾病领域,针对患者未满足的临床需求,如肿瘤、消化道及代谢、呼吸、心脑血管等领域慢病用药(图一)。
本土药企构建自主研发体系,本土新药走向国际实现突破
多家大型本土药企每年研发费用达到10亿元以上,研发投入占营业收入比例在10%以上。领先本土药企在海内外建立了多个研发中心,建立完整的自主创新体系。过去三年,本土药企研发上市的I类新药逐年增加,分别达到了10个(2018年)、12个(2019年)和15个(2020年)。
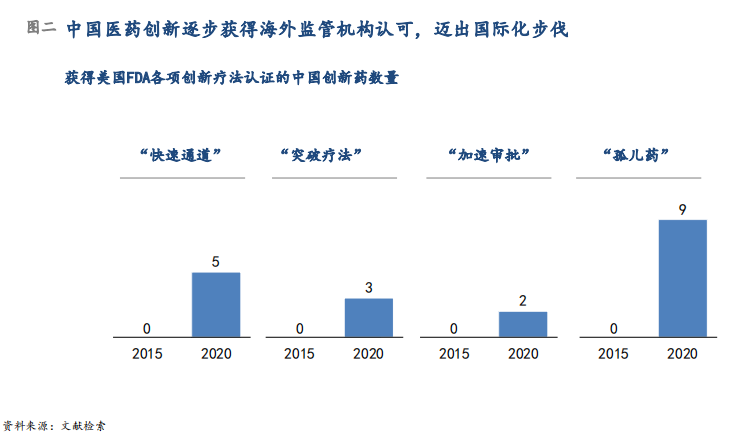
中国药企开展的国际多中心临床试验数量上也从2015年的48项增加到2019年的131项;覆盖地区上从2015年的14个国家和地区增加到2019年的51个国家和地区。中国创新药企研发药物获得美国FDA多项加速审批与孤儿药资质(图二),其中百济神州自主研发的抗癌新药泽布替尼,在多项加速认证的助推下,成为第一个在美国获批上市的中国公司自主研发的创新药。此外,重磅授权合作也推动了中国创新药走向全球市场。2020年代表性案例包括信达生物授予礼来PD-1单抗达伯舒中国以外地区商业化权益,天境生物授予艾伯维CD47单抗TJC4中国以外地区临床开发和商业化权益等。
跨国药企升级中国研发中心为创新中心,展开广泛本土合作
跨国药企中国研发从以注册新药实现上市销售为目的转变为与欧美同步开展研发的创新基地。跨国创新药企已在中国设立了25个研发中心,每年在华研发投资超过120亿元,中国研发中心成为跨国药企全球创新药研发的重要组成部分,并在中国培养了大批本土研发人才。例如,投资8.63亿元的罗氏上海创新中心落成,成为罗氏全球第三大战略中心,未来将把基于中国的研发成果带向全世界;赛诺菲在苏州设立在中国的首个全球研究院,预计未来五年每年投资额达到1.6亿元;早在2005年就在上海设立的辉瑞研发中心,从以职能部门为主的支持性角色,到参与辉瑞全球创新药研发。跨国药企中国研发中心与国际各研究机构、各领域专家紧密合作,有中国参与的创新药临床研究不断增加,通过参与全球同步开发引进新药的模式逐步实现。例如,抗纤维化治疗药物乙磺酸尼达尼布软胶囊三项新适应证,都在中国实现了全球同步递交,并基于有中国患者参加的III期国际多中心临床试验结果在中国获批。跨国药企积极开展多元化的创新合作模式,与高校、科研机构以及生物科技公司等合作发现新技术和新疗法;通过授权许可交易,加大与本土药企在研发上的合作力度;通过投资基金,更早介入中国本土创新药物的研发前沿。例如,强生在上海落成JLABS,是强生第一个在北美以外建立的孵化器,提供高效灵活的创新平台;诺和诺德在北京建立INNOVO平台,与中国本土科研机构与初创企业协同创新;阿斯利康在无锡落位I·Campus,与政府合作共建生命科学产业园。2020年被称为中国创新国际化的历史元年,本土企业与跨国药企的合作数量(超过80多项)、规模和质量都达到了前所未有的高度。
临床研究能力提升
顶级临床期刊发表文章数增加:中国专家在顶级医学期刊《柳叶刀》及《新英格兰医学杂志》发表文章数量呈增长趋势,从2015年的137篇增长到2020年的302篇。参与临床的主要研究者数量增加:2017-2019年,累计约1300名中国研究者参加了临床试验,10%的中国研究者参与过至少一个国际多中心临床试验。以肿瘤为例,中国主要研究者在美国临床肿瘤学会年会做口头报告的次数从2015年的1次增加到2019年的6次。
基础研究成果增加
基础科研顶级刊物发文数量持续增长:由中国研究团队主导或共同主导发表在《自然》《科学》《细胞》三大学术期刊上的研究性论文数量2020年达到150篇。中国的医药创新相关专利申请数量位居世界前列。根据世界知识产权组织发布的《世界知识产权指标》统计,在2015-2019年间,中国生物技术专利申请数达9,500件,药品专利申请数达18,800件,医疗技术专利申请数达16,600件,均位列全球前两位。
中国医药创新产出“量”增已至,“质”升可期
量:创新管线贡献全球第二,首发上市新药全球第三
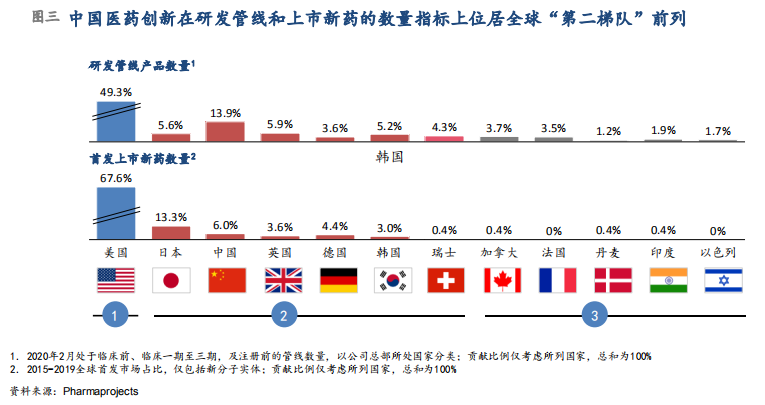
对医药创新数量及对全球的贡献衡量包括研发管线产品数量和全球首发上市新药数量两个指标。以研发管线产品数量衡量(根据2020年2月研发状态处于临床前、临床I至III期及上市注册前的分子数,按研发公司总部所在国分类),中国对全球贡献占比已达到13.9%,而这一贡献比例在2015年只有4.1%,2018年为7.8%。2020年,中国已经稳居第二梯队之首,而且与第一梯队美国的差距有所缩小(美国2020年占比49.3%)。以全球首发上市新药数量(2015-2019年,只计入新分子实体)衡量,中国在12个主要对标国家中位列全球前三,占比6.0%,而这一贡献比例和历史水平相比也有所提高(2007-2015年只有2.5%)(图三)。
质:快速跟进渐进创新为主,同质创新现状有待突破
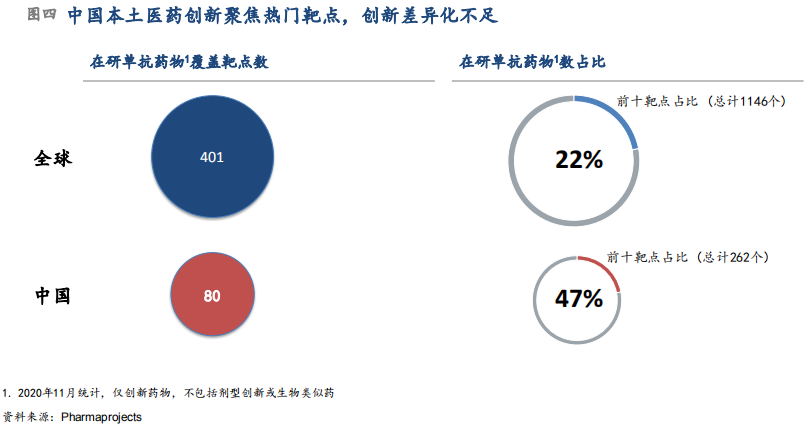
中国目前主要处于快速跟进的渐进式创新阶段。中国本土创新落后国际首创新药的上市时间在逐渐缩短,2020年相较2015年的差距在代表性靶点上已缩短近一半时间(从8-10年缩短至4-6年)。但是全球首创新药数量仍然非常有限,2017-2020年中国上市的37个I类新药中,仅3个在作用机制上实现创新(目前尚未在美国上市)。中国研发聚集于热门靶点现象明显,普遍存在同质化创新现象。以单抗药物为例,目前全球活跃在研单抗药物覆盖靶点共计约400个,中国药企研发管线覆盖仅为其中五分之一。围绕相对成熟“热门”靶点的研发在中国更加集中,如针对前十大靶点的在研单抗药物数量占比在全球为22%,在中国这一比例高达47%(图四)。究其原因,现阶段主要受到本土原创能力相对薄弱和资本投入风险偏好的制约;长期来看,随着中国本土研发创新能力的持续提升以及市场对于差异创新回报的显现,同质化创新的情况将会得到缓解。(摘自《构建中国医药创新生态系统》系列报告)
(责任编辑:刘思慧)
