

生物医药|2020年生物医药政策环境简述
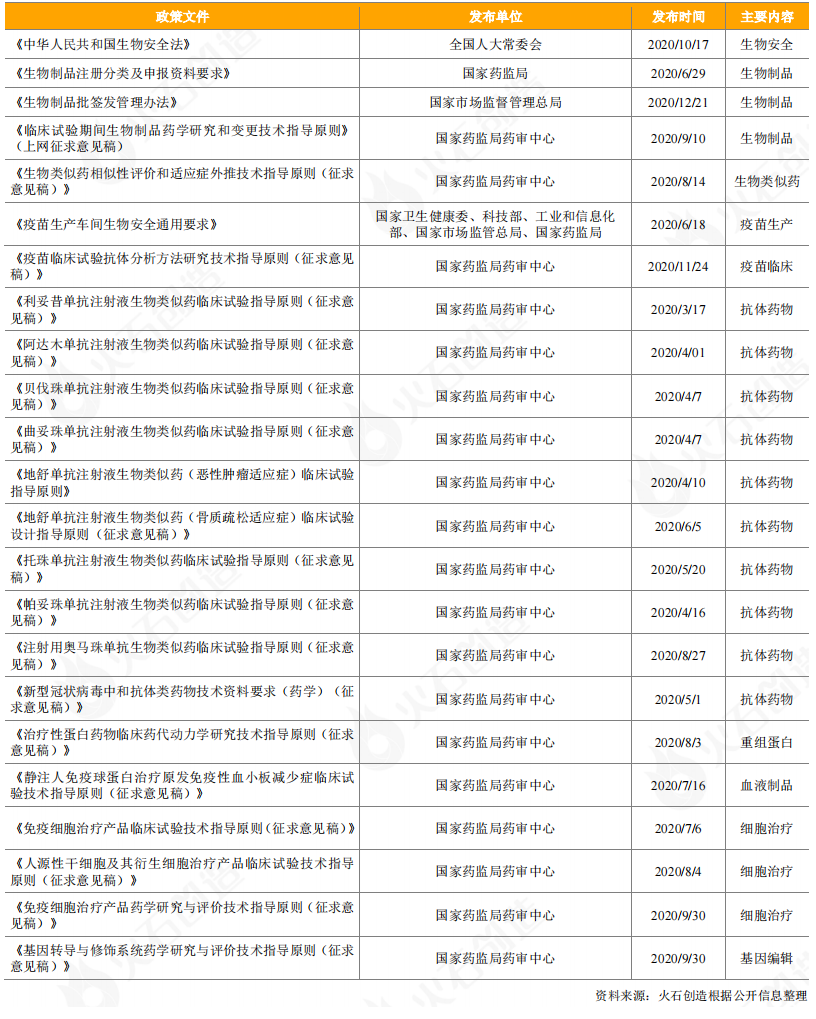
2020年,我国出台了一系列涉及生物药领域的政策,进一步规范和促进生物药的发展。
生物安全作为国家安全的重要组成部分,被提到了空前高度。2020年10月17日,为了防范和应对生物安全风险,保障人民生命健康,保护生物资源和生态环境,促进生物技术健康发展,实现人与自然和谐共生,十三届全国人大常委会第二十二次会议通过了《中华人民共和国生物安全法》,自2021年4月15日起施行。
从整个生物药领域来看,生物药的注册审批和批签发管理不断规范。为配合新修订《药品注册管理办法》的实施,国家药监局于2020年6月发布了《生物制品注册分类及申报资料要求》。2020年12月,国家市场监督管理总局发布新修订《生物制品批签发管理办法》,自2021年3月1日起施行,以加强生物制品监督管理,规范生物制品批签发行为,保证生物制品安全、有效。为规范生物制药临床研究和申报,国家药监局药审中心分别于2020年8月和2020年9月公布了《生物类似药相似性评价和适应症外推技术指导原则(征求意见稿)》和《临床试验期间生物制品药学研究和变更技术指导原则》(上网征求意见稿),向社会各界公开征求意见。
从细分领域来看,疫苗、抗体、细胞和基因治疗是国家指导的重点领域:
疫苗领域,国家卫生健康委、科技部、工业和信息化部、国家市场监管总局、国家药监局五部门于2020年6月18日联合发布了《疫苗生产车间生物安全通用要求》,作为新冠肺炎疫情防控期间推动新冠疫苗生产的临时性应急要求。2020年11月24日,CDE组织起草了《疫苗临床试验抗体分析方法研究技术指导原则(征求意见稿)》公开征求意见,旨在进一步规范和指导疫苗临床试验抗体分析的研究。
抗体药物领域,CDE发布了涉及利妥昔单抗、阿达木单抗、贝伐珠单抗、曲妥珠单抗、地舒单抗、托珠单抗、帕妥珠单抗、奥马珠单抗等抗体药物的临床试验指导原则,为国内相关单抗生物类似药的临床研发提供参考。
重组蛋白领域,为切实鼓励创新,进一步指导治疗性蛋白药物的临床研发,CDE组织起草了《治疗性蛋白药物临床药代动力学研究技术指导原则(征求意见稿)》并公开征求意见,以期为治疗性蛋白药物的临床药代动力学研究提供可参考的技术规范。
血液制品领域,为指导和规范静注人免疫球蛋白用于治疗原发免疫性血小板减少症的临床试验,CDE组织起草了《静注人免疫球蛋白治疗原发免疫性血小板减少症临床试验技术指导原则(征求意见稿)》并公开征求意见。
在细胞和基因治疗领域,CDE制定了免疫细胞治疗产品、人源性干细胞及其衍生细胞治疗产品的临床试验技术指导原则,以及免疫细胞治疗产品、基因转导与修饰系统的药学研究与评价技术指导原则。
2020年生物药领域政策
(责任编辑:刘思慧)
